Turma 57 da EPED
Dezasseis alunos fantásticos que se instalaram, de "almas e bagagens", no coração da professora Bárbara!
quarta-feira, maio 06, 2009
segunda-feira, julho 14, 2008
Quase Técnicos
Quanto aos módulos recuperados, apenas dois alunos não conseguiram recuperar todos os módulos, a saber:
Nº 1704 - Física e Química, Mód. 8
Nº 1712 - Matemática, Mód. 6
terça-feira, fevereiro 13, 2007
Doseamento da acidez fixa de um vinho comercial por potenciometria
O método potenciométrico apresenta grande vantagem na análise quantitativa de vinhos tintos uma vez que, nestes casos, não é possível detectar visualmente a alteração de cor do indicador.
Assim, o pH-metro fornece a leitura dos valores de pH em função do volume gasto e, deste modo, consegue-se detectar instrumentalmente o ponto de equivalência da titulação.
De qualquer modo, nas aulas práticas apenas um grupo analisou vinho tinto; os restantes analisaram vinhos brancos e, por isso, a adição de 2 gotas de fenolftaleína permitiu também a detecção visual do ponto final da titulação.
sexta-feira, fevereiro 02, 2007
sexta-feira, janeiro 19, 2007
sexta-feira, janeiro 12, 2007
sábado, janeiro 06, 2007
Análise de uma Água Oxigenada
Depois de padronizado o permanganato de potássio, procedeu-se à análise de uma água oxigenada.
Encheu-se a bureta com a solução de permanganato e colocou-se, num Erlenmeyer, 20 ml de água oxigenada diluída (1:10) e 10 ml de água sulfúrico também diluído (1:4).
Na titulação gastaram-se cerca de 30 ml de permanganato.
Limpeza do excesso de permanganato
Preparação da solução de ácido sulfúrico
Titulação da água oxigenada
Ponto final da titulação - mudança de incolor para cor-de-rosa claro
Mais 1 valor para a primeira pessoa a dizer-me os volumes da água oxigenada comercial analisada! ;)
Volumetrias de Oxidação-Redução - Padronização da Solução de Permanganato de Potássio
Depois de uma experiência menos boa em que se obtiveram os resultados mais estranhos, no último dia já foi possível realizar o doseamento de uma água oxigenada através de uma permanganometria.
Primeiro, preparou-se uma nova solução de permanganato de potássio, a qual ficou alguns dias em repouso.
Preparação do KMnO4
A solução preparada foi, então, padronizada com solução de ácido oxálico (0,15 g de ácido para 25 ml de água desionizada), na presença de ácido sulfúrico 2 M (15 ml). Lavou-se e secou-se muito bem todo o material, de forma a eliminar possíveis contaminações
Secagem do material de vidro
Enchimento da Bureta com KMnO4
A padronização deve ser efectuada a cerca de 70ºC de modo a ser mais rápida.
Controlo da T(placa de agitação e aquecimento)
quarta-feira, novembro 22, 2006
A Prova do Crime!
Pois é, aqui está a "prova do crime" ;) A prova de que a turma 57 é mesmo 5*****!
Como ficam bonitos assim, todos concentrados na resolução de problemas. Gostei particularmente do vosso ar sereno e confiante na hora de atacar os "bichos-feios" ;) E espero que no teste de amanhã haja notas muito boas! :)
Boa visita de estudo da parte da manhã. Portem-se bem! ;)
terça-feira, novembro 14, 2006
Determinação da Dureza Cálcica de uma Água
A dureza total de uma água está relacionada com a quantidade de iões cálcio (dureza cálcica) e magnésio (dureza magnesiana) nela presentes. Neste trabalho, determinámos a dureza cálcica através de uma volumetria de complexação, tendo como titulante uma solução de EDTA 0,01 M. O indicador usado foi o murexide, que preparámos triturando 0,2 g deste reagente puro com 100 g de cloreto de sódio, previamente seco na estufa e arrefecido num exsicador.
P.S. Andreia, fico à espera "daquela" fotografia! :)
Determinação da Dureza Total de uma Água
Numa volumetria de complexação, a adição de titulante à solução a titular origina um complexo solúvel e estável. Este tipo de volumetria permite determinar, entre outras coisas, a dureza total de uma água, expressa em ppm (mg / L) de Carbonato de Cálcio (CaCO3).
A dureza de uma água está relacionada com a sua capacidade de fazer espuma:
- Águas macias ou brandas, inferior a 75 ppm (estas águas fazem muita espuma com pouco detergente);
1. Procura de reagentes e respectivos Rs e Ss; 2. Pormenor de um caderno de laboratório; 3. Efeito Tyndall - dispersão da luz na presença das poeiras do laboratório; 4. Início do trabalho.
Neste trabalho, a solução titulante utilizada foi o EDTA 0,01 M e o indicador foi o Negro de Eriocrómio T.
domingo, outubro 22, 2006
Há Ciência na Fnac
As Ciências Físico-Químicas, as Ciências da Vida e da Terra, as Ciências do Céu e do Universo, a Matemática e a História das Ciências são as temáticas que servem de mote a este encontro marcado com a Ciência, ao qual nenhum de vós vai querer faltar!
Na área das Ciências Físico-Químicas, salientam-se os seguintes livros:
- À Boleia com Isaac Newton, Barry Parker, Edições 70 - Explicações dos conceitos de Física envolvidos no funcionamento dos automóveis (17,01€);
Podem, ainda encontrar, um kit denominado Modelos Moleculares - O Essencial da Química (8,41 €) para construção de modelos moleculas a 3 dimensões e investigação das propriedades estruturais das moléculas.
Para quem quer aprender mais sobre Ciência Forense, a Fnac ainda tem compactos em DVD da série CSI - Crime Sob Investigação.
sábado, outubro 21, 2006
Determinação de Cloretos num Sal de Cozinha pelo Método de Charpentier-Volhard
O Método de Charpentier-Volhard é um dos métodos utilizados em volumetria de precipitação e distingue-se dos restantes pela formação de um complexo corado e solúvel que dá cor à solução.
Depois de filtrada a mistura, e de lavado o precipitado com ácido nítrico diluído, o filtrado e os líquidos de lavagem são recolhidos num Erlenmeyer.
É neste Erlenmeyer que se encontra o ião prata excedente que não reagiu com os cloretos e que vai ser titulado com solução-padrão de tiocianato de potássio, na presença do indicador sulfato de ferro e amónio hidratado. Trata-se, pois, de uma titulação de retorno que origina um precipitado branco de AgSCN.
Logo após ter precipitado todo o ião prata excedente, o ião tiocianato reage com o ião ferro do indicador, formando o ião complexo [Fe(SCN)]2+.
sábado, outubro 07, 2006
Determinação de Cloretos num Sal de Cozinha pelo Método de Mohr
Primeiramente, foi necessário preparar soluções de Nitrato de Prata e padronizá-las. No primeiro turno, tal tarefa coube ao Gonçalo; no segundo, à Sílvia e à Tatiana.
Ensaio a branco
Titulação de padronização do Nitrato de Prata
Para a padronização da solução de Nitrato de Prata, foi necessário uma solução de Cloreto de Sódio, a qual foi preparada pela Cinda e pela Cláudia (primeiro turno) e pelo grupo da Pipa, Tiago e Andreia (segundo turno).
Pesagem do Cloreto de Sódio
Por fim, depois de padronizado o Nitrato de Prata, efectuaram-se as titulações que permitiram determinar o teor de Cloretos numa amostra de sal de cozinha.
Realização de um ensaio de titulação
Turno 2
Vários momentos do trabalho
O Método de Mohr diferencia-se dos demais métodos de volumetria de precipitação pela formação de um segundo precipitado cor-de-tijolo, o qual funciona como indicador do ponto final da titulação e ocorre logo após a precipitação completa do precipitado branco de Cloreto de Prata.
Precipitados branco e cor-de-tijolo
Por fim, relembro que os cálculos do teor de cloretos são para ser apresentados e discutidos na aula da próxima 2ª Feira. Quem tiver dúvidas, reveja a resolução dos problemas da última aula teórico-prática.
segunda-feira, setembro 18, 2006
Regresso à Escola
Espero que as vossas férias tenham sido boas. Já sei, já sei... foram curtas, não é? ;) Mas o importante mesmo é que tenham sido bem aproveitadas :)
Para aqueles que estão já ansiosos pelo regresso à EPED, boas notícias! É que as aulas começam esta semana! Dia 21 de Setembro, 5ª Feira, será o primeiro dia.
E 3ª Feira já deverão sair as notas dos testes de recuperação.
Beijinhos da Stôra Bárbara!
terça-feira, julho 11, 2006
A Sílvia na Televisão!!!!!!
 Ia jurar que a Sílvia apareceu agora mesmo numa reportagem da SIC acerca do Programa Ciência Viva no Verão, promovido pela Fundação para a Ciência e a Tecnologia (FCT) do Ministério da Ciência, Tecnologia e Ensino Superior.
Ia jurar que a Sílvia apareceu agora mesmo numa reportagem da SIC acerca do Programa Ciência Viva no Verão, promovido pela Fundação para a Ciência e a Tecnologia (FCT) do Ministério da Ciência, Tecnologia e Ensino Superior.Tentem ver o telejornal da SIC, hoje às 20h. Talvez volte a passar a reportagem :)
E, Sílvia, grande representação da EPED! :) Achei curioso estares a ter essa formação com 3 estudantes da Escola Secundária da Namaacha pois são da minha terra!!! :)
Beijinhos da "Stôra"!
domingo, julho 02, 2006
Últimas notas
Finalmente, com a vistoria final feita a todos os cadernos de laboratórios, posso respirar fundo e dizer-vos as notas dos módulos 5+6 de Análises Químicas! Ufa!!!! Estava difícil :-/
Devo só acrescentar que o Gonçalo foi penalizado por faltas injustificadas e a Paula T. por não ter apresentado caderno de laboratório.
10 - Ana
12 - Cláudia
10 - Daniela
15 - Pipa
13 - Gi
12 - Gonçalo
16 - Li
11 - Paula A.
19 - Rute
13 - Sílvia
13 - Tati
12 - Tiago
14 - Tita
18 - Cinda
16 - Paula T.
18 - Andreia
Relativamente aos testes de recuperação de 6ª Feira, temos:
Gonçalo - 10.9
Beijinhos e boas férias! :)
sexta-feira, junho 30, 2006
Notas... muitas notas!
Mas ainda faltam algumas... vou agora atacar as de Análises Químicas ;)
Módulo 3 de Física e Química
Nº 1697 - 11.3
Nº 1699 - 11.4
Nº 1702 - 15.2
Nº 1703 - 13.9
Nº 1704 - 15.7
Nº 1705 - 14.3
Nº 1708 - 12.6
Nº 1709 - 19.7
Nº 1710 - 14.9
Nº 1711 - 14.8
Nº 1712 - 16.5
Nº 1713 - 14.4
Nº 1714 - 19.5
Nº 1715 - 19.7
Nº 1724 - 14.9
Nº 1700 - 13.5
Módulo 2 de Análises Químicas - Recuperações 2º Período
Nº 1703 - 9.8
Módulo 2 de Química Aplicada - Recuperações 2º Período
Nº 1700 - 12.4
segunda-feira, junho 26, 2006
Ligação Peptídica
Nas proteínas, o grupo carboxilo (C=O) alfa de um aminoácido une-se à amina (NH2) alfa de outro por uma ligação denominada peptídica ou amídica. A ligação peptídica une dois aminoácidos resultando na formação de um dipeptídeo com a perda de uma molécula de água.
A cadeia polipeptídica possui um sentido orientado. Como os aminoácidos que constituem a cadeia possuem terminações diferentes, por convenção, a ponta amínica (grupo alfa-amina) é considerada como sendo o início de uma cadeia peptídica, e a ponta carboxílica (grupo alfa-carboxilo) o fim.
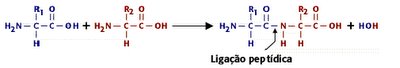
Uma cadeia peptídica é constituída por uma parte que se repete regularmente e à qual damos o nome de cadeia principal; e uma parte que varia de aminoácido para aminoácido, que corresponde às cadeias laterais distintas.

As proteínas são sintetizadas como uma sequência de aminoácidos unidos numa estrutura poliamídica linear (polipeptídeo), mas assumem uma configuração tridimensional complexa ao realizarem as suas funções. O conhecimento sobre a estrutura das proteínas deve-se, em grande parte, a Emil Fischer (1852-1919), que verificou que estas são formadas pela condensação de muitas moléculas de a-aminoácidos através das referidas ligações peptídicas.
A ligação entre duas moléculas de aminoácidos gera um dipeptídeo, da mesma forma que três moléculas de aminoácidos formam um tripeptídeo. Assim, é de esperar que as proteínas sejam polipetídeos que resultam da condensação de milhares de moléculas de aminoácidos.
Trabalho elaborado pelo aluno:
Gonçalo Antunes Nº 1704
sexta-feira, junho 23, 2006
Notas do teste de Química Aplicada
Mais umas notas para a turma 57 ;) As notas da ficha surpresa estão a cor-de-rosa.
Nº 1702 - 15.4 e 11.3

Nº 1703 - 16.2 e 11.3
Nº 1704 - Faltou 11.3
Nº 1705 - 10.5 e 9.8
Nº 1708 - 11.6 e 11.3
Nº 1709 - 16.9 e 16.0
Nº 1710 - 13.1 e 12.4
Nº 1711 - 14.6 e 10.9
Nº 1712 - 14.6 e 13.6
Nº 1713 - 10.3 e 15.8 ----> Boa recuperação!
Nº 1714 - 18.5 e 17.3
Nº 1715 - 18.5 e 17.0
Nº 1724 - 15.4 e 15.5













































